近日,AG真人农学院、亚热带农业生物资源保护与利用国家重点实验室、岭南现代农业科学与技术广东省实验室刘耀光院士/祝钦泷研究员团队在国际著名学术期刊Plant Biotechnology Journal(影响因子11.6, 生物/工程技术1区)在线发表了题为“PhieDBEs: a DBD-containing, PAM-flexible, high-efficiency dual base editor toolbox with wide targeting scope for use in plants”的研究论文。

该研究在前期开发的单碱基编辑器PhieCBEs和PhieABEs基础上,利用高活性胞嘧啶脱氨酶(evoFERNY)和腺嘌呤脱氨酶(TadA8e)、单链DNA结合结构域(DBD)与广靶向的SpCas9缺刻酶变体SpGn,成功开发了一套广靶向的植物高效双碱基编辑器PhieDBEs(plant high-efficiency dual base editors),进一步完善了植物基因编辑工具箱。此外,通过不同组合方式将功能元件DBD融合在双碱基编辑器不同位置,探究了其最佳融合位置和拷贝数,为开发多元件多重功能的基因编辑工具提供了重要参考。
基于CRISPR/Cas9系统开发的单碱基编辑器(BEs)能够在不需要供体模板及不造成双链DNA断裂的条件下实现单碱基替换,提高了基因编辑的精确性,但由于实现的碱基替换类型过于单一,不利于内源基因的快速驯化和目标基因的饱和突变筛选。而将胞嘧啶脱氨酶和腺嘌呤脱氨酶同时融合到SpCas9缺刻酶(SpCas9n)所获得的双碱基编辑器(DBE),能够同时实现A-to-G和C-to-T转换,丰富靶位点的突变类型,进一步扩大了碱基编辑的应用范围。但其仍然存在SpCas9n靶向范围窄(识别NGG-PAM)、双碱基同步发生编辑的效率较低等问题,限制了DBEs在植物中的广泛应用。
为了克服DBEs目前存在的问题,该研究基于广靶向的SpCas9n变体SpGn(识别NG-PAM),利用高活性胞苷脱氨酶evoFERNY和腺苷脱氨酶TadA8e,以及人源RAD51 DBD的不同融合方式,构建了由9个编辑器组成的一系列DBE-SpGn载体(图1)。在水稻中设计了48个NGN PAM的靶点对DBE-SpGn 的编辑效率进行系统性检测,结果发现在SpGn的N端融合了单拷贝DBD的C-A-D-SpGn平均编辑效率最高达41.9%(2.4%~95.2%)比C-A-SpGn的平均编辑效率33.7%(2.1%~75.0%)显著提高,表明当两种脱氨酶和单拷贝DBD均位于SpGn的N端时能更有效地实现双碱基编辑。融合了双拷贝DBD的C-D-SpGn-D-A和A-D-SpGn-D-C的平均编辑效率仅2.3%(0~14.9%)和10.8%(0~54.6%),这表明多拷贝的DBD并不能提高编辑效率,还会因功能元件较多而导致的空间位阻抑制了DBEs发挥有效功能。此外,将脱氨酶融合在C端则使其对应产生的碱基脱氨频率大幅度降低,而融合在复合体N端时更有利于其发挥功能,说明脱氨酶也具有明显的N端位置优势。
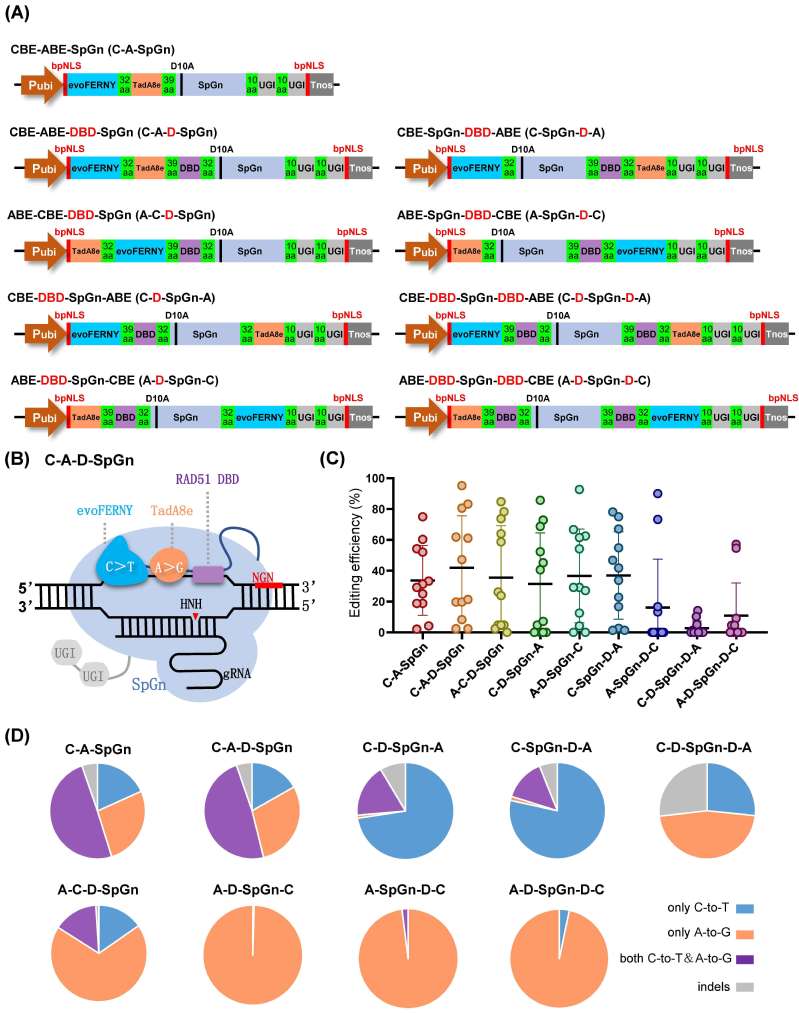
图1.双碱基编辑器DBE-SpGn的结构与编辑特征。(A)DBE-SpGn的载体结构图;(B)C-A-D-SpGn的工作示意图;(C)DBE-SpGn分别在12个测试的水稻内源靶点的编辑效率;(D)各个载体在靶点范围内所产生的不同的碱基编辑产物。
从DBE-SpGn载体中筛选出能够高效产生A-to-G&C-to-T同步替换的一组双碱基编辑器(C-A-SpGn,C-A-D-SpGn和A-C-D-SpGn),将其命名为PhieDBEs。其中C-A-D-SpGn在靶点V2TS6-TGW6上编辑效率最高可达95.2%,并且A-to-G&C-to-T同时替换的概率最高达81.0%。此外,PhieDBEs的C-to-T和A-to-G编辑窗口趋于一致,主要口集中在M5-M9(M=A/C),C-A-SpGn和C-A-D-SpGn在主要窗口外的A3处也显示较高的编辑活性(图2)。与此前大部分研究报道的碱基编辑器相较而言,PhieDBEs编辑窗口变窄,更有利于进行精准编辑。最后,该研究对PhieDBEs的多种编辑特性进行了分析,结果表明能够高效靶向NG PAM,并且在靶点内对A或C的编辑都不存在明显的序列背景偏好性,使用一个载体能够实现多个靶点同时产生多种类型的碱基替换等优点。
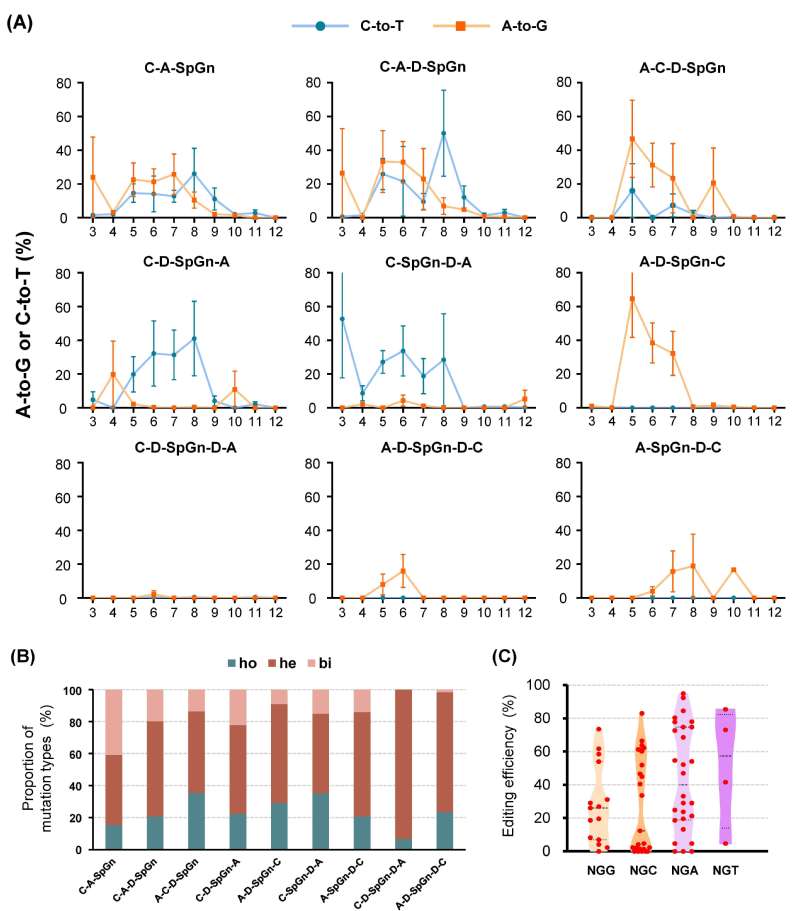
图2. PhieDBEs在靶位点产生有效的双碱基转换。(A)的编辑活性窗口;(B)DBE-SpGn所产生的的突变类型比例;(C)DBE-SpGn在四种NGN-PAM靶位点的编辑效率。
该研究通过两个高活性脱氨酶和广靶向的SpGn变体,以及RAD51 DBD的组合,开发了一套植物高效广靶向的双碱基编辑系统 PhieDBEs,揭示了功能元件DBD的最优融合条件及其对邻近脱氨酶的影响,以及脱氨酶自身具有的位置效应,为开发多元件多重功能的碱基编辑器提供了重要参考。PhieDBEs表现出比目前已报道的植物双碱基编辑器更优异的编辑活性和较窄的编辑窗口,有利于实现更加准确的核苷酸替换和特定的氨基酸转变,这将为植物功能突变体的筛选提供更多可选择工具,进一步完善了植物高效碱基编辑系统工具箱。
博士生郑芷晔和刘涛利,博士后柴楠为该论文的共同第一作者,祝钦泷研究员与刘耀光院士为论文的共同通讯作者。该研究得到了国家重点研发计划项目、国家自然科学基金项目、广东省“十四五”农业科技创新十大重点项目、岭南现代农业实验室项目、广东省基础与应用基础研究重大项目和广东省大学生科技创新战略专项资金(“攀登计划”专项资金)的资助。
相关论文信息:https://onlinelibrary.wiley.com/doi/full/10.1111/pbi.14438
文图/农学院


